Schwächen des Bohrschen Atommodells
Die grösste Schwäche war wohl, dass man die Quantisierung des Drehimpulses nicht wirklich erklären konnte. Sie war nur ein Postulat. Erst als die Wellennatur des Elektrons bekannt wurde, konnte man die Drehimpulsquantisierung erklären.Dieses Modell ist aber inkonsistent, denn nach der klassischen Elektrodynamik erzeugt eine kreisende Ladung elektromagnetische Wellen, mit denen Energie abgestrahlt wird. Folglich würde jedes kreisende Elektron Energie verlieren und müsste auf einer Spiralbahn in den Kern stürzen.Grenzen vom Schalenmodell: Das Schalenmodell lässt sich gut auf Wasserstoffatome anwenden, stößt bei schwereren Atomen allerdings auf seine Grenzen. Obwohl die Elektronen in der Realität nicht auf definierten Bahnen um den Atomkern kreisen, wird das Schalenmodell dennoch oft für Erklärungen herangezogen.
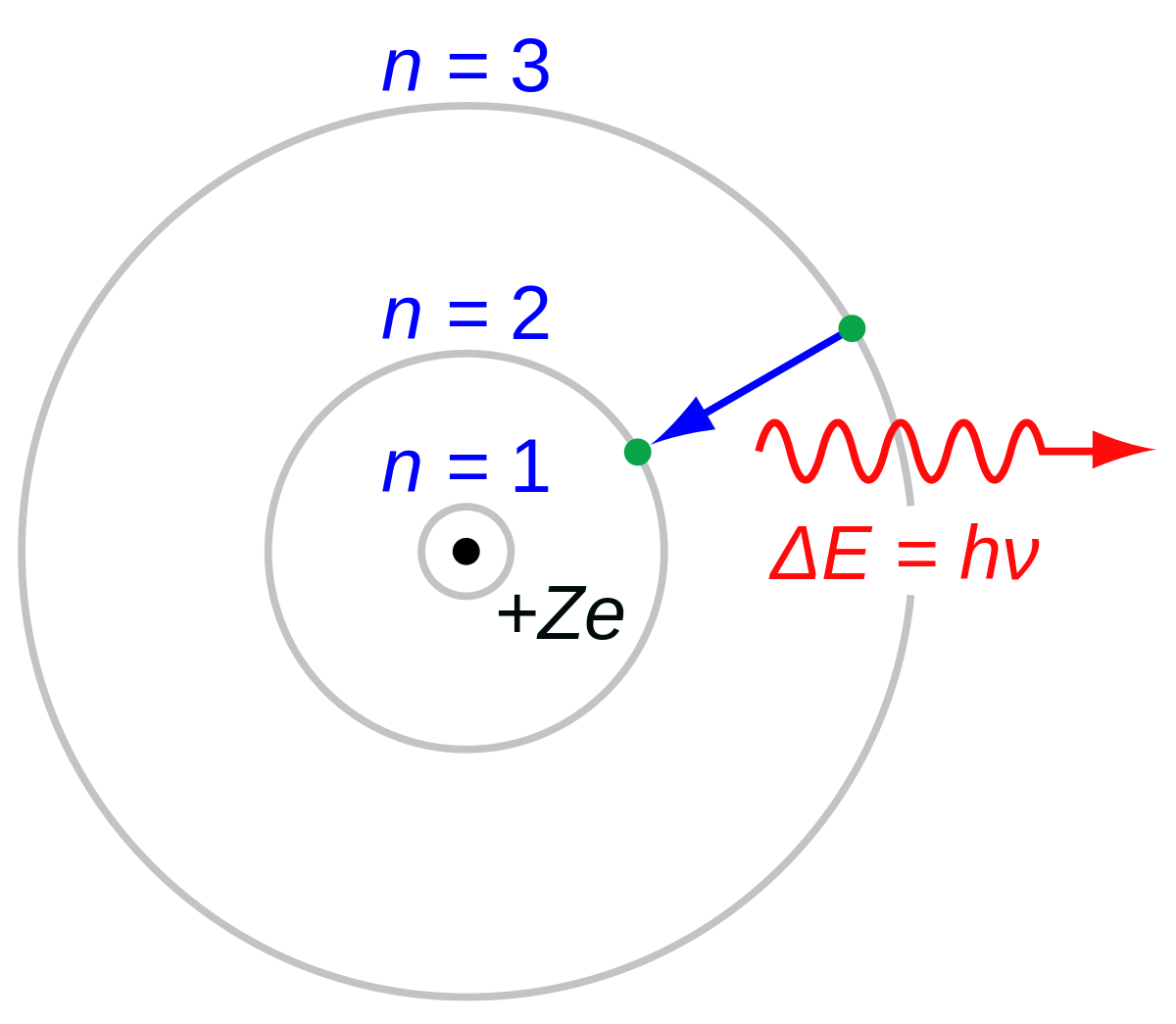
Wo versagt das Bohrsche Atommodell : Das Bohrsche Modell versagt jedoch bei Atomen mit mehr als einem Elektron. Schon beim Helium stimmen die berechneten Frequenzen nicht mit den Spektrallinien überein. Nach Bohr bewegt sich ein Elektron auf einer Kreisbahn, also in einer Ebene, um den Atomkern.
Was bringt das Bohrsche Atommodell
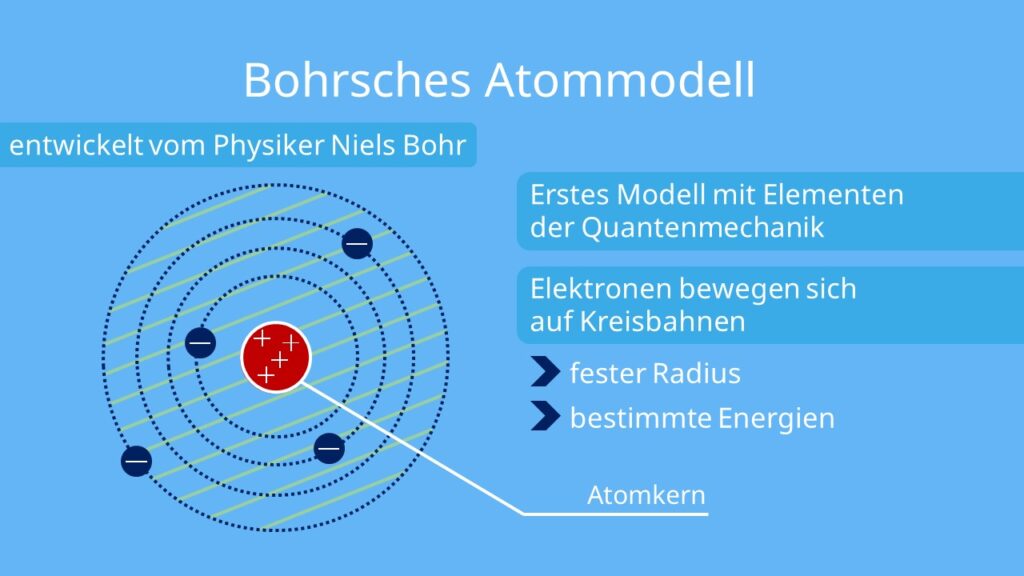
Das Bohrsche Atommodell wurde im Jahr 1913 von Niels Bohr entworfen und soll dabei helfen, den Atomaufbau besser zu verstehen. Nach dem Bohrschen Atommodell umkreisen die negativ geladenen Elektronen in bestimmten Abständen den positiv geladenen Atomkern.
Wo liegen die Grenzen des bohrschen Atommodells : Problem der höheren Elemente
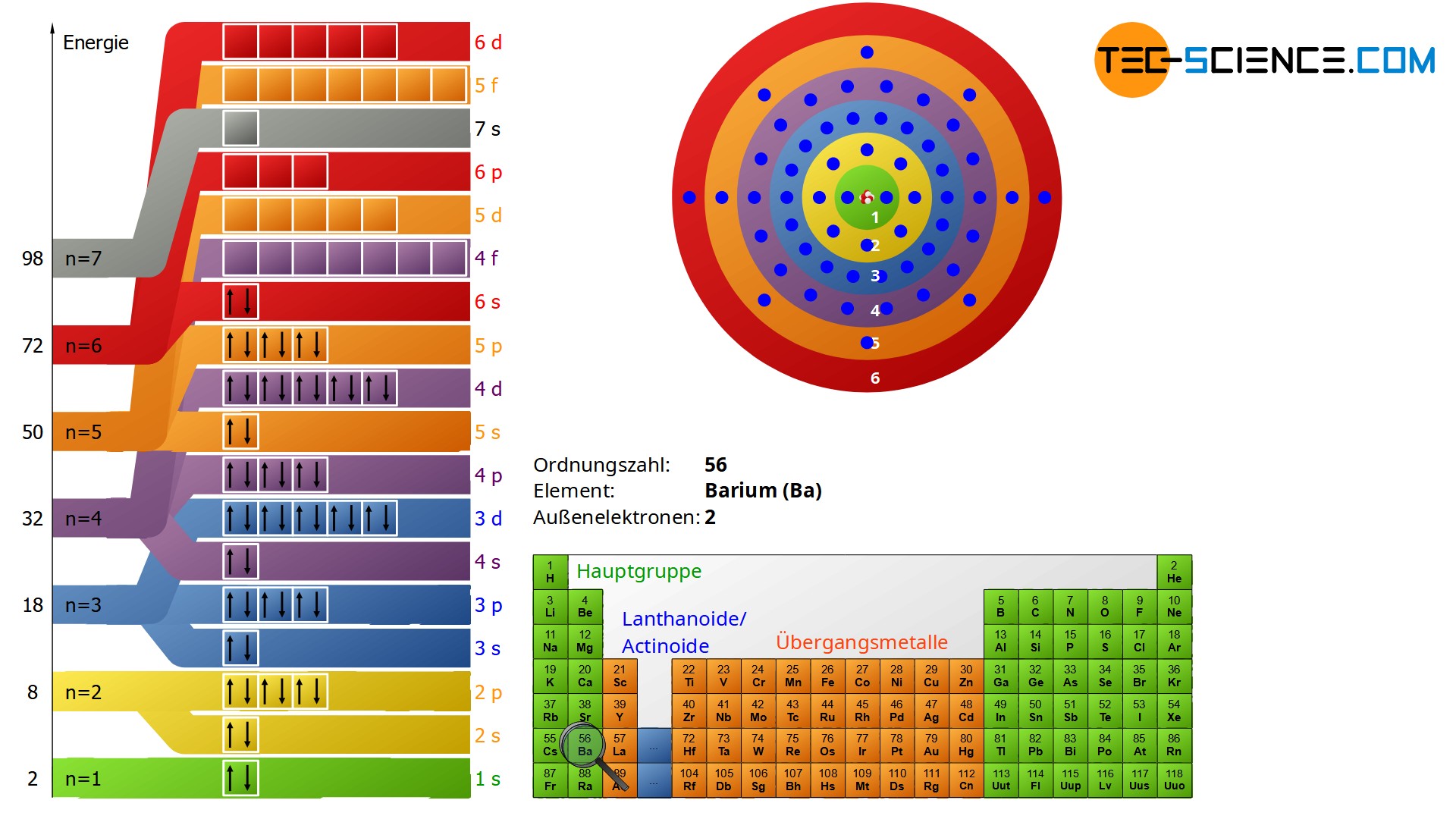
Leider konnte mit Hilfe des Bohr'schen Atommodells nur das Spektrum des Wasserstoffatom exakt berechnet werden. Die höheren Elemente erforderten neue Quantenzahlen: l, m und s. Mit ihnen konnten die höheren Spektren zwar prinzipiell erklärt aber nicht exakt errechnet werden.
Die äußerste (siebente) Elektronenschale, auch Valenzschale genannt, kann zwischen ein und acht Elektronen aufnehmen. Somit befinden sich insgesamt 32 chemische Elemente in der siebente Periode.
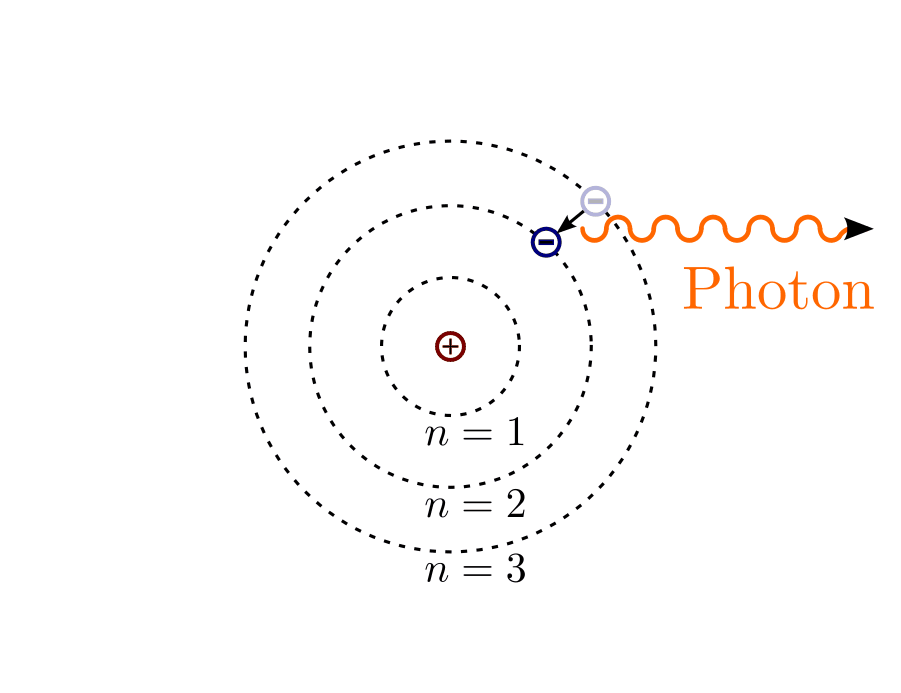
Beim Atommodell nach Bohr kreisen die Elektronen auf festen Bahnen um den Atomkern. Die Elektronen können aber zwischen den einzelnen Bahnen hin- und herspringen. Bei diesem Vorgang wird Energie frei, bzw. benötigt, die als elektromagnetische Welle emittiert bzw.
Warum heißen die Schalen Klmnop
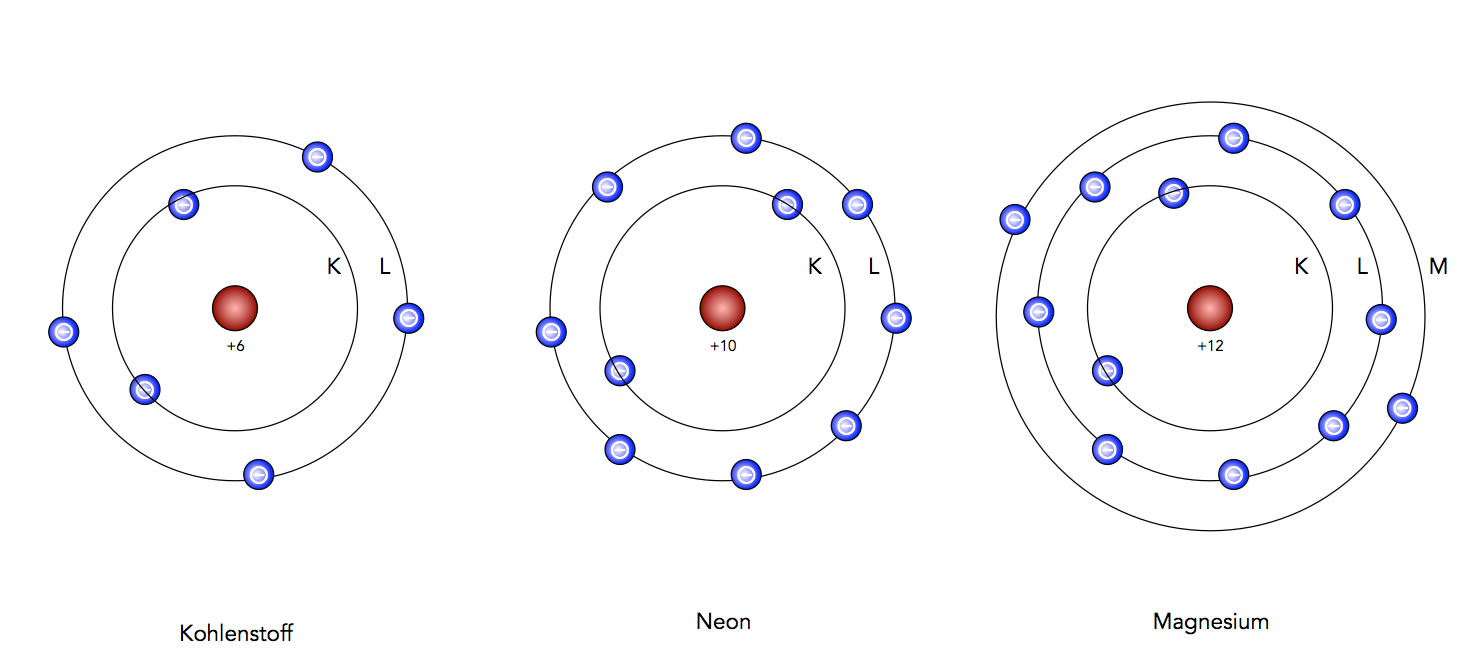
Das Schalenmodell (oder auch Atommodell nach Bohr) begründet auf der Annahme, dass die Elektronen den Atomkern in bestimmten Abständen umkreisen. Diese Aufenthaltsräume werden Schalen genannt. Sie werden ausgehend vom Atomkern K-, L-, M-, N- Schale usw. bezeichnet.32
In der 4. Schale (N-Schale) sind maximal 32 Elektronen untergebracht (4s, 4p, 4d und 4f)Das aktuelle Atommodell ist das Resultat der Quantenmechanik und wird als Orbitalmodell bezeichnet. Orbitale sind Raumbereiche, in denen sich Elektronen mit einer gewissen Wahrscheinlichkeit aufhalten. Diese Orbitale ersetzen die Bahnen des Bohrschen Atommodells.
Die äußerste (fünfte) Elektronenschale, auch Valenzschale genannt, kann zwischen ein und acht Elektronen aufnehmen. Somit befinden sich insgesamt 18 chemische Elemente in der fünften Periode.
Wie viele Elektronen dürfen auf die 4 Schale : 32
In der 4. Schale (N-Schale) sind maximal 32 Elektronen untergebracht (4s, 4p, 4d und 4f)
Wie viele Elektronen auf der 5 Schale : Die vierte Elektronenschale besitzt mindestens acht Elektronen und kann maximal 18 Elektronen aufnehmen. Die äußerste (fünfte) Elektronenschale, auch Valenzschale genannt, kann zwischen ein und acht Elektronen aufnehmen. Somit befinden sich insgesamt 18 chemische Elemente in der fünften Periode.
Wie heißt die 6 Schale
Die fünfte Elektronenschale hat mindestens 8 Elektronen und kann maximal 18 Elektronen aufnehmen. Die äußerste (sechste) Elektronenschale, auch Valenzschale genannt, kann zwischen ein und acht Elektronen aufnehmen. Somit befinden sich insgesamt 32 chemische Elemente in der sechsten Periode.
erste Schale: K-Schale, Platz für 2 Elektronen. zweite Schale: L-Schale, Platz für 8 Elektronen. dritte Schale: M-Schale, Platz für 18 Elektronen. vierte Schale: N-Schale, Platz für 32 Elektronen.Atome mit mehr als 18 Elektronen
| Elektronen | in Schale |
|---|---|
| 49 bis 54 | 5 |
| 55 bis 56 | 6 |
| 57 | 5 |
| 58 bis 71 | 4 |
Wie viele Elektronen passen in die 8 Schale : Die Anzahl der Elektronen im Atom
Die wiederum lässt sich an der Ordnungszahl im Periodensystem ablesen. Ein Beispiel: Sauerstoff hat die Ordnungszahl 8, also 8 Protonen im Atomkern und dementsprechend auch 8 Elektronen in seiner Hülle.