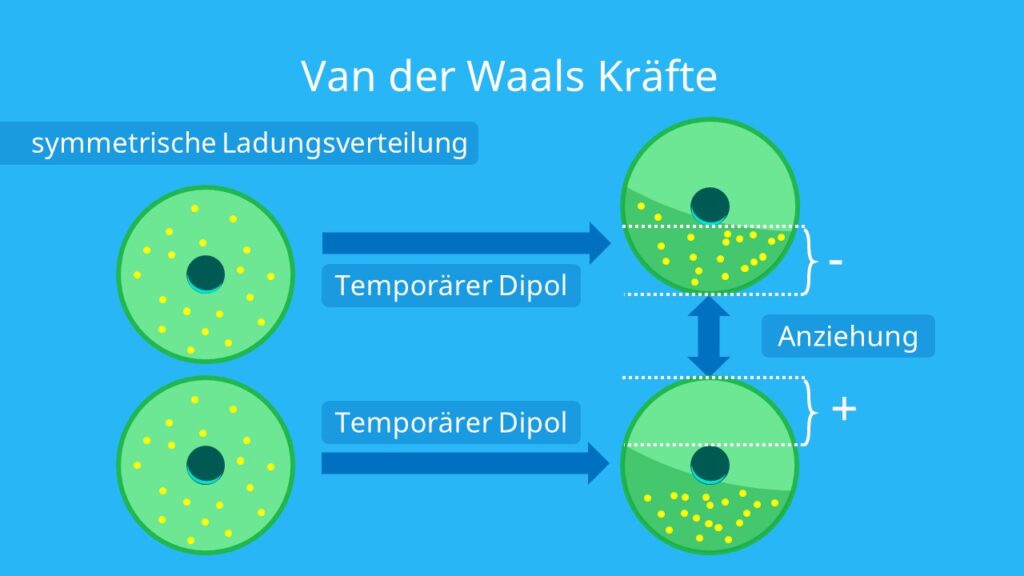
Mit Van-der-Waals-Kräften, benannt nach dem niederländischen Physiker Johannes Diderik van der Waals (1837–1923), bezeichnet man die relativ schwachen nicht-kovalenten Wechselwirkungen zwischen Atomen oder Molekülen, deren Wechselwirkungsenergie mit etwa der sechsten(!) Potenz des Abstandes abfällt.Alkanmoleküle sind unpolar, es gibt also keinen Ladungsschwerpunkt im Molekül. Deshalb wirken zwischen den Molekülen auch nur schwache Kräfte, die Van-der-Waals-Kräfte . Daher sind die Siede- und Schmelztemperaturen der Alkane auch im Vergleich zu polaren Molekülen wie Alkoholen sehr niedrig.Zwischenmolekulare Wechselwirkungen sind keine Bindungen und treten zwischen verschiedenen Molekülen auf. Sie beruhen auf der elektrostatischen Anziehung, wonach sich positive und negative Ladungen anziehen.
Wann gibt es keine Van-der-Waals-Kräfte : Eine permanente Ladungsverschiebung, also ein permanenter Dipol, entsteht dann, wenn die Elektronegativitätsdifferenz der Bindungspartner recht hoch ist. In diesem Fall können keine VdW-Kräfte auftreten.
Welche Van-der-Waals-Kräfte gibt es
Zwischenmolekulare Kräfte
Die Aufteilung der van der Waals Kräfte erfolgt in drei Arten: Keesom-Wechselwirkung zwischen zwei Dipolen (Dipol-Dipol-Kräfte ) Debye-Wechselwirkung zwischen einem Dipol und einem polarisierbaren Molekül (Dipol-induzierter-Dipol-Kräfte)
Sind Van-der-Waals und London Kräfte das gleiche : Die London-Kräfte werden oft auch als Van-der-Waals-Kraft im engeren Sinne bezeichnet.
Van der Waals Kräfte sind Wechselwirkungen, die zwischen verschiedenen Atomen und/oder Molekülen auftreten. Sie sind relativ schwache, nicht-kovalente Wechselwirkungen. Das bedeutet, dass sie im Vergleich zu Atom- oder Ionenbindungen schwächer sind.
Physikalische Eigenschaften der Alkene / Alkine:
Entsprechen denen der Alkane, da auch Alken- und Alkinmoleküle unpolare Moleküle sind zwischen denen nur van-der-Waals-Kräfte wirken.
Wann steigen die Van-der-Waals-Kräfte
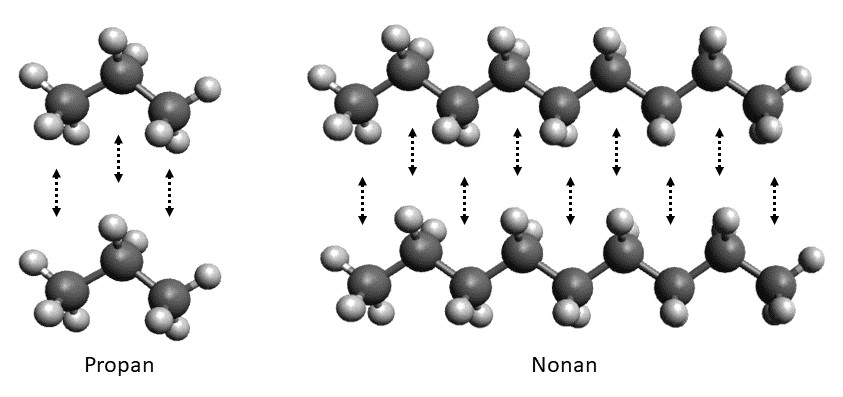
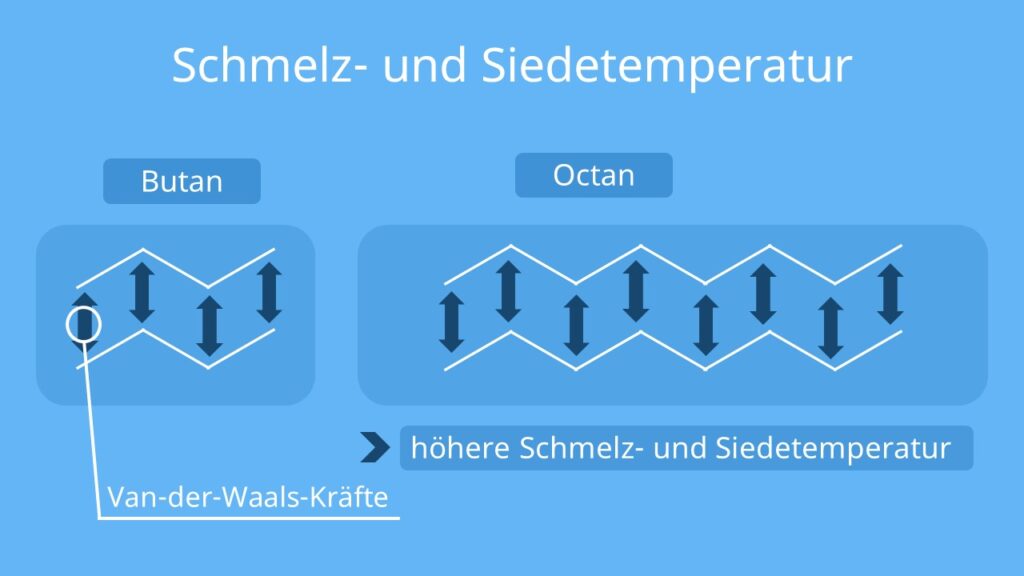
Je länger die Kette der Kohlenstoffatome ist, desto größer ist dementsprechend die Berührungsfläche zwischen den Molekülen. Je größer die Berührungsfläche, desto stärker sind die van der Waals Kräfte.Bei der Dipol-Dipol-Wechselwirkung wirken zwei permanente Dipole aufeinander ein. Permanente Dipole entstehen, wenn die Bindungspartner einer Atombindung eine Elektronegativitätsdifferenz von über 0,4 besitzen. Ein Dipol besitzt immer einen positiv und einen negativ geladenen Pol, ähnlich wie ein Magnet.Dabei kamen die Forscher zu einem interessanten Ergebnis: Zwischen den Wassermolekülen wirken Van-der Waals Kräfte, welche entscheidend für die Geometrie und Flexibilität der Wasserstoffbrücken sind.
Zwischenmolekulare Wechselwirkungen treten nicht nur zwischen gleichartigen Atomen und Molekülen auf, sondern auch zwischen Molekülen unterschiedlicher Phasen und/oder Oberflächen. Die London-Kräfte werden oft auch als Van-der-Waals-Kraft im engeren Sinne bezeichnet.
Warum heißen Van-der-Waals-Kräfte jetzt London-Kräfte : Unter London-Kräften versteht man bei der quantenmechanischen Beschreibung der chemischen Bindung die schwachen Anziehungskräfte zwischen ungeladenen, unpolarisierten Atomen und Molekülen. Sie sind benannt nach dem Physiker Fritz London (1900–1954).
Warum heißen die Van-der-Waals-Kräfte jetzt London-Kräfte : Unter London-Kräften versteht man bei der quantenmechanischen Beschreibung der chemischen Bindung die schwachen Anziehungskräfte zwischen ungeladenen, unpolarisierten Atomen und Molekülen. Sie sind benannt nach dem Physiker Fritz London (1900–1954).
Welchen Einfluss haben die Van-der-Waals-Kräfte auf die Eigenschaften der Alkane
Van-der-Waals-Kräfte in Alkanen
Der Einfluss der Van-der-Waals-Kräfte lässt sich am Beispiel der Alkane verdeutlichen: Mit zunehmender Kettenlänge nimmt der Siedepunkt zu. So hat Ethan zum Beispiel einen Siedepunkt von -88,6 °C, während n-Heptan einen Siedepunkt von 98,4 °C hat.
Allerdings gibt es einen großen Unterschied. Während bei den Alkanen nur Einfachbindungen zwischen den Kohlenstoff-Atomen vorliegen, findest du bei den Alkenen (mindestens) eine Doppelbindung zwischen zwei Kohlenstoff-Atomen.Die Dipol-Dipol-Wechselwirkungen sind stärker als die reinen Van-der-Waals-Kräfte, allerdings schwächer als die Wasserstoffbrückenbindungen.
Sind Dipol Dipol Van-der-Waals-Kräfte : Dipol-Dipol-Wechselwirkungen zählen zu den stärksten Van-der-Waals-Kräften und somit auch zu den zwischenmolekularen Wechselwirkungen. Insgesamt sind sie deutlich schwächer als die kovalente Bindung, die Metallbindung und die Ionenbindung.