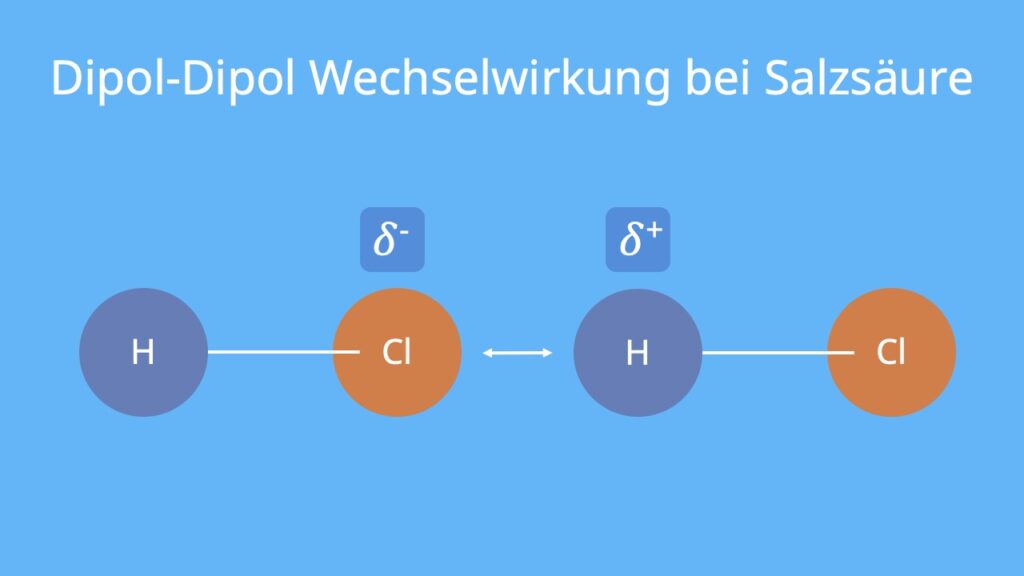
Dipole bezeichnen in der Chemie Moleküle, in denen zwei entgegengesetzte Pole in Form von Teilladungen (Partialladungen) auftreten. Du sprichst hierbei auch von positiv und negativ geladenen Polen. Dipole können permanent im Molekül vorhanden sein, aber auch durch äußere Einflüsse hervorgerufen werden.Entstehung einer Dipol-Dipol-Wechselwirkung
Befinden sich zwei permanente Dipole nebeneinander, zum Beispiel wenn zwei Moleküle aneinanderliegen, wechselwirken diese. Entgegengesetzte Pole ziehen sich nämlich an, auch das kennst du von zwei Magneten. Eine solche Anziehung ist die Van-der-Waals-Wechselwirkung.Wann ist ein Molekül ein Dipol Ein Molekül ist dann ein Dipol, wenn es im Molekül mindestens eine polare Atombindung gibt. Gibt es mehrere solche Bindungen, dürfen sich die Dipolmomente der einzelnen Bindungen nicht gegenseitig aufheben, sonst ist das Molekül insgesamt gesehen kein Dipol.
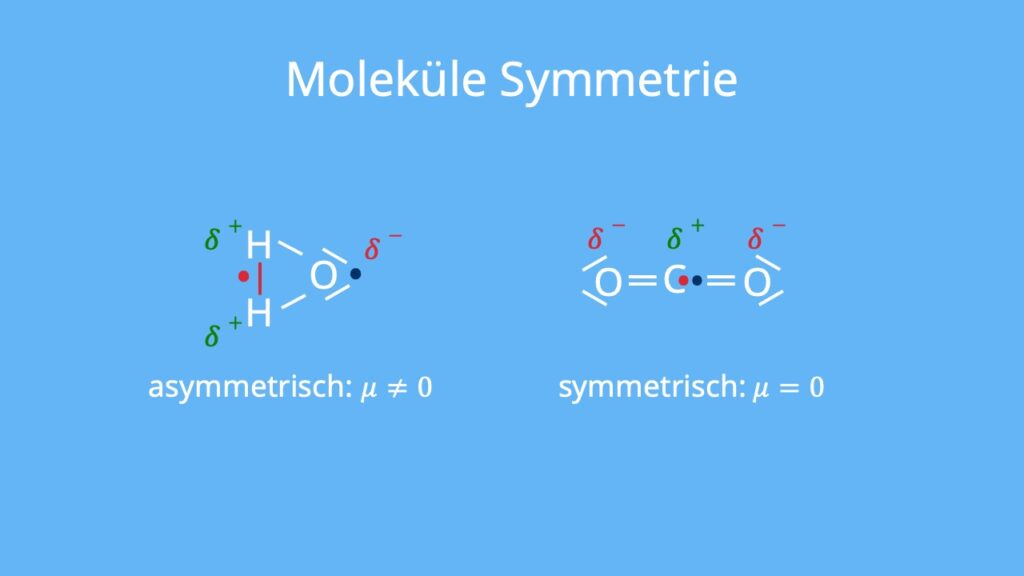
Wann ist es ein Dipol und wann nicht : Neben zwei polaren H-O-Bindungen tragen hier auch zwei freie Elektronenpaare zum Dipolmoment bei. Allgemein kann gesagt werden, dass Moleküle mit einem asymmetrischen Aufbau und einem ΔEN größer 0,4 und kleiner 1,7 als Dipol erscheinen, d. h. sie sind zwar nach außen elektrisch neutral, haben aber ein Dipolmoment.
Was ist ein Dipol Beispiel
Das Wassermolekül ist eines der bekanntesten Beispiele für einen Dipol in der Chemie. Es besteht aus zwei Wasserstoff-Atomen und einem Sauerstoff-Atom, die nicht in einer Linie ausgerichtet sind. Aufgrund der höheren Elektronegativität des Sauerstoff-Atoms wird die elektronische Ladung hin zum Sauerstoff verschoben.
Wann gibt es Dipol Dipol Kräfte : Die sogenannten Wasserstoffbrückenbindungen (auch Wasserstoffbrücken) sind eine Sonderform der Dipol-Dipol-Kräfte. Sie treten nur zwischen Molekülen auf, in denen Wasserstoff an ein stark elektronegatives Element, wie zum Beispiel Fluor, Sauerstoff oder Stickstoff, gebunden ist.
Die sogenannten Wasserstoffbrückenbindungen (auch Wasserstoffbrücken) sind eine Sonderform der Dipol-Dipol-Kräfte. Sie treten nur zwischen Molekülen auf, in denen Wasserstoff an ein stark elektronegatives Element, wie zum Beispiel Fluor, Sauerstoff oder Stickstoff, gebunden ist.
Das Wassermolekül ist eines der bekanntesten Beispiele für einen Dipol in der Chemie. Es besteht aus zwei Wasserstoff-Atomen und einem Sauerstoff-Atom, die nicht in einer Linie ausgerichtet sind. Aufgrund der höheren Elektronegativität des Sauerstoff-Atoms wird die elektronische Ladung hin zum Sauerstoff verschoben.
Wo findet man Dipol-Dipol-Kräfte
Gibt es starke Unterschiede in der Ladungsverteilung eines Moleküls, führt das zu stärkeren Anziehungskräften zwischen zwei gleichartigen Molekülen. Außerdem gilt: Je geringer der Abstand zwischen zwei benachbarten Molekülen ist, desto stärker sind die dort auftretenden Dipol-Dipol Wechselwirkungen.Kohlenstoffdioxid (CO2) Kein Dipolmolekül, da das Molekül linear gebaut ist, fallen die Ladungsschwerpunkte von allen positiven und negativen Teilladungen (δ+ und δ -) im Kohlenstoffatom zusammen.Wie funktioniert ein Hertzscher Dipol An den beiden Enden des Hertzschen Dipols bilden sich entgegengesetzte Ladungen aus. Es entsteht eine Spannung und ein elektrisches Feld. Dadurch fließt ein Strom durch den Dipol, der wiederum ein magnetisches Feld erzeugt, das sich kreisförmig um den Dipol ausbildet.
Ionen sind als Ladungsträger grundsätzlich "polar", d. h. Salze sind stets polare Stoffe. Liegen in einem Molekül nur polarisierte Atombindungen vor, so addieren sich die einzelnen Dipolmomente der Bindungen vektoriell zu einem Gesamtdipolmoment.
Was macht ein Dipol aus : In der Chemie werden Moleküle, bei denen die Schwerpunkte der negativen und der positiven Ladungsträger nicht zusammenfallen, als Dipole bezeichnet (Dipol-Moleküle). Wassermoleküle sind typische Dipole. In der Medizin verhalten sich erregte Herzmuskelzellen zu unerregten wie ein Dipol.
Wann ist etwas ein Dipol : Dipole sind Teilchen, die zwei entgegengesetzte Pole aufweisen. In der Chemie sprechen wir bei diesen Polen von positiv und negativ geladenen Polen. Zwei wichtige Dipolarten sind der permanente und der temporäre Dipol.
Ist ein Dipol immer polar
Von außen betrachtet, hat das Ensemble (aus den 2 Atomen und der zwischen ihnen verlaufenden Bindung) einen Pluspol und einen Minuspol. Dinge, die 2 Pole besitzen, heißen Dipol. Die eben beschriebene Bindung ist also ein Dipol. Solche Bindungen nennt man auch polar.