Noch heute wird der sogenannte Bohrsche Atomradius deshalb als Größe in der Atomphysik benutzt. In der Quantenmechanik ordnet man den Elektronen jedoch keine festen Bahnen mehr zu, sondern wolkenförmige Orbitale.Nach dem Thomsonschen Atommodell besteht das Atom aus einer gleichmäßig verteilten positiven Ladung und negativ geladenen Elektronen, die sich darin bewegen. Dieses Modell wird auch als Plumpudding-Modell oder zu deutsch Rosinenkuchenmodell bezeichnet.Die ersten Atommodelle
Dieses „Rosinenmodell“ wurde 1903 von J. J. THOMSON weiterentwickelt: Er ging davon aus, dass sich die Elektronen um den Kern auf Ringen befinden und für jedes Element eine stabile Verteilung der Elektronen existiert. Mit diesen Modellen konnte man erklären, dass ein Atom elektrisch neutral ist.
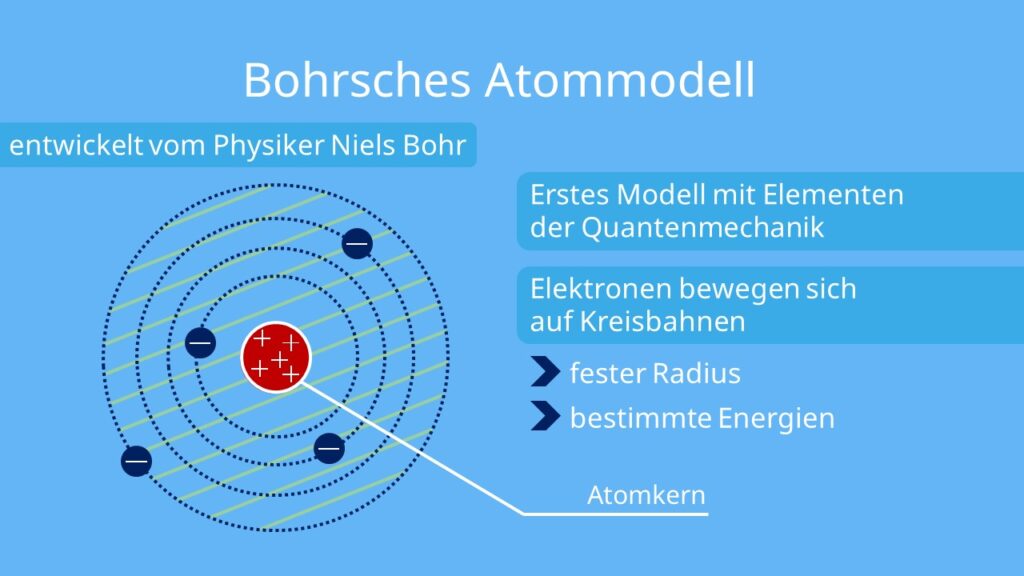
Was ist der Unterschied zwischen Bohr und Rutherford : Im Rutherford Atommodell gab es keine plausiblen Erklärungen für die Stabilität der Elektronen in der Atomhülle. Im Gegensatz dazu erklärt das Bohrsche Atommodell durch Einführung der stationären Zustände und diskreten Energieniveaus die Stabilität der Elektronen und verhindert somit, dass sie in den Kern stürzen.
Ist das Bohrsche Atommodell noch aktuell
Drei Grundaussagen des Bohrschen Modells wurden aber bis heute in alle Atommodelle übernommen: Elektronen halten sich im Atom nur in definierten Bereichen auf, Bohrs Bahnen haben sich dabei zu den heutigen Orbitalen weiterentwickelt.
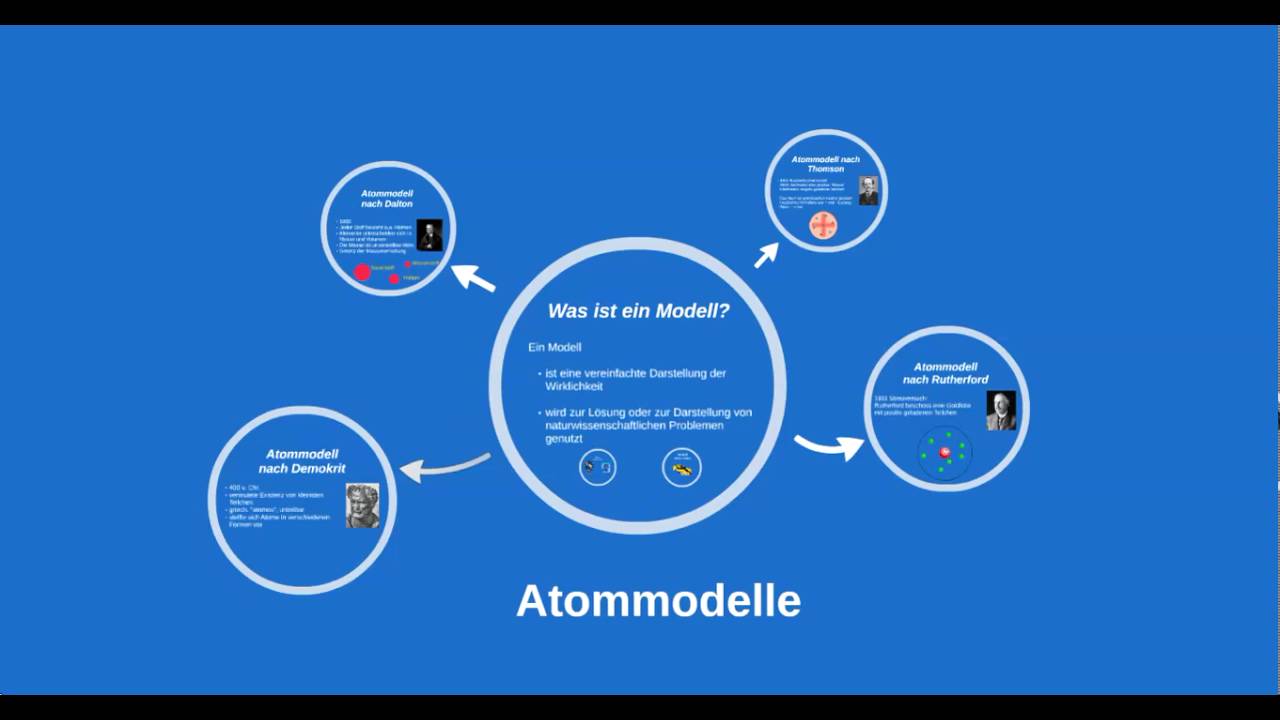
Welche 5 Atommodelle gibt es : Atommodelle Übersicht
- Teilchenmodell von Demokrit (5. Jhdt. v. Chr.)
- Daltons Atomhypothese (1803)
- Atommodell von Thomson (1904)
- Rutherfordsches Atommodell / Kern Hülle Modell (1911)
- Bohrsches Atommodell / Schalenmodell (1913)
- Orbitalmodell (1928)
Dieses Modell ist aber inkonsistent, denn nach der klassischen Elektrodynamik erzeugt eine kreisende Ladung elektromagnetische Wellen, mit denen Energie abgestrahlt wird. Folglich würde jedes kreisende Elektron Energie verlieren und müsste auf einer Spiralbahn in den Kern stürzen.
Dieses Modell ist aber inkonsistent, denn nach der klassischen Elektrodynamik erzeugt eine kreisende Ladung elektromagnetische Wellen, mit denen Energie abgestrahlt wird. Folglich würde jedes kreisende Elektron Energie verlieren und müsste auf einer Spiralbahn in den Kern stürzen.
Was konnte Bohr nicht erklären
Chemische Bindungen können mit Bohrs Modell nicht verstanden werden. sein, tatsächlich ist er aber 0. Die geradzahlige Aufspaltung vieler Spektrallinien unter dem Einfluss von Magnetfeldern (anomaler Zeeman-Effekt) kann nicht erklärt werden.Mit einem Versuch konnte Rutherford die Annahme der Ladungsverteilung im Atommodell nach Dalton widerlegen. Das Atommodell nach Rutherford geht davon aus, dass Atome aus einem kleinen, massereichen Atomkern bestehen. Die Elektronen bewegen sich in einer großen Hülle um diesen Atomkern.Die Kernaussagen von Daltons Atommodell : Jeder Stoff besteht aus kleinsten, nicht weiter teilbaren kugelförmigen Teilchen, den Atomen. Alle Atome eines Elements haben das gleiche Volumen und die gleiche Masse. Die Atome unterschiedlicher Elemente unterscheiden sich in ihrem Volumen und in ihrer Masse.
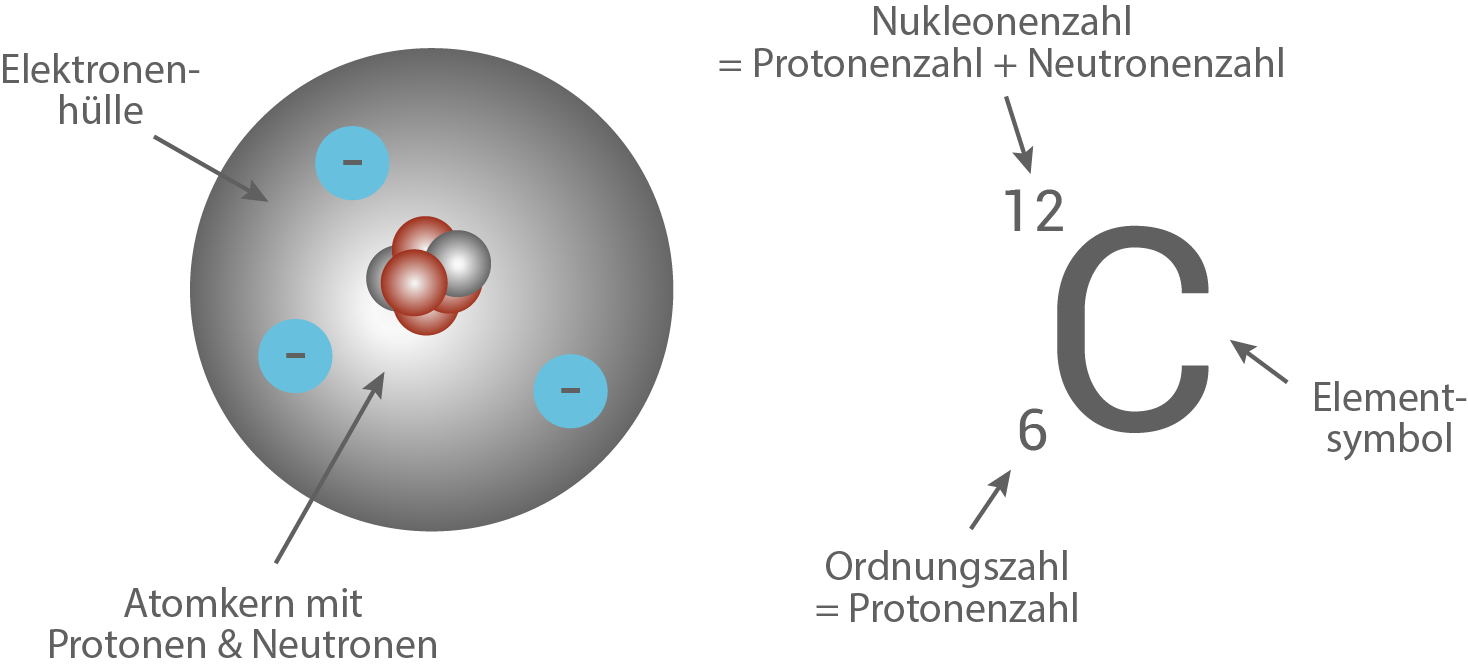
Das Wasserstoff- Atom. Mehr (H) ist das kleinste und am einfachsten aufgebaute Atom. Es besteht lediglich aus einem Proton.
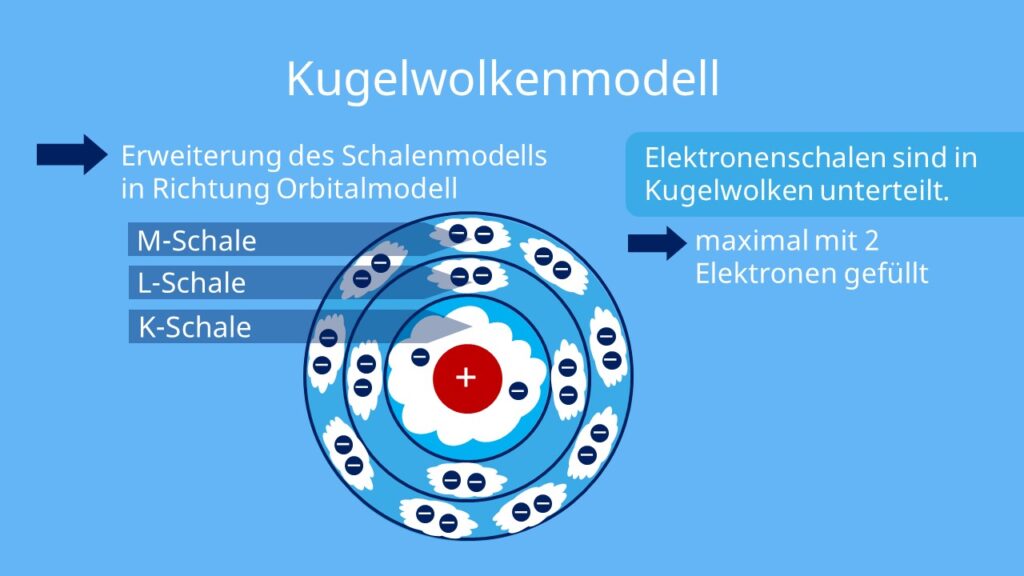
Welches Atommodell gilt heute noch : Das aktuelle Atommodell ist das Resultat der Quantenmechanik und wird als Orbitalmodell bezeichnet. Orbitale sind Raumbereiche, in denen sich Elektronen mit einer gewissen Wahrscheinlichkeit aufhalten. Diese Orbitale ersetzen die Bahnen des Bohrschen Atommodells.
Welche Schwächen hat das Bohrsche Atommodell : Das Problem des Bohrschen Atommodells ist, dass es aus quantenmechanischer Sicht inkonsistent ist. Insbesondere verletzt es eines der fundamentalen Gesetze der Quantenmechanik, nämlich die Heisenbergsche Unschärferelation.
Warum ist das Atommodell von Bohr falsch
Dieses Modell ist aber inkonsistent, denn nach der klassischen Elektrodynamik erzeugt eine kreisende Ladung elektromagnetische Wellen, mit denen Energie abgestrahlt wird. Folglich würde jedes kreisende Elektron Energie verlieren und müsste auf einer Spiralbahn in den Kern stürzen.
Eine weitere Einschränkung des Dalton Atommodells betrifft die Vorhersage der chemischen Reaktionen. Während das Modell erklären konnte, dass Atome in einer chemischen Reaktion nur umorganisiert werden, konnte es nicht vorhersagen, welche Arten von Atomen in einer gegebenen chemischen Reaktion beteiligt sein würden.Man nennt dieses Modell auch "Rosinenkuchen-Modell", da die Elektronen in der homogenen, positiven Ladungsverteilung wie die Rosinen in einem Teig erscheinen. Aus Gründen der Stabilität gelangte Thomson durch Rechnungen zur Forderung, dass die Elektronen regelmäßig angeordnet sein müssten.
Welches Atom kommt weltweit am häufigsten vor : Die Häufigkeit der Elemente unterscheidet sich je nach betrachtetem System stark voneinander. Wird das gesamte Universum betrachtet, ist Wasserstoff das mit Abstand häufigste Element mit etwa 90 %.