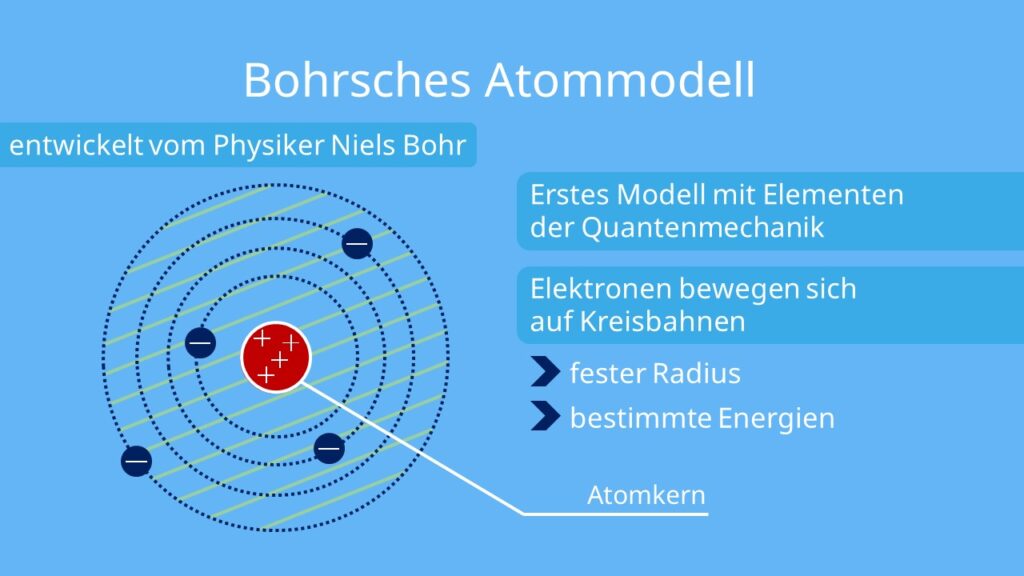
Dieses Modell ist aber inkonsistent, denn nach der klassischen Elektrodynamik erzeugt eine kreisende Ladung elektromagnetische Wellen, mit denen Energie abgestrahlt wird. Folglich würde jedes kreisende Elektron Energie verlieren und müsste auf einer Spiralbahn in den Kern stürzen.Mit dem Bohrschen Atommodell lassen sich keine Aussagen zum Emissions- und Absorptionsverhalten von Atomen mit mehr als einem Elektron treffen. Das bedeutet, das Modell ist nur für Wasserstoff und Ionen mit einem Elektron gültig. Für Mehrelektronensysteme ist es ungeeignet.Das Bohrsche Modell versagt jedoch bei Atomen mit mehr als einem Elektron. Schon beim Helium stimmen die berechneten Frequenzen nicht mit den Spektrallinien überein. Nach Bohr bewegt sich ein Elektron auf einer Kreisbahn, also in einer Ebene, um den Atomkern.
Was sind die Grenzen des bohrschen Atommodells : Grenzen vom Schalenmodell: Das Schalenmodell lässt sich gut auf Wasserstoffatome anwenden, stößt bei schwereren Atomen allerdings auf seine Grenzen. Obwohl die Elektronen in der Realität nicht auf definierten Bahnen um den Atomkern kreisen, wird das Schalenmodell dennoch oft für Erklärungen herangezogen.
Ist das Bohrsche Atommodell aktuell
Bohr war in der Lage mit seinem Modell das Spektrum des Wasserstoffatoms theoretisch zu erklären. Sein Modell scheiterte an den neuen Ergebnissen der Quantenmechanik. Das aktuelle Atommodell ist das Resultat der Quantenmechanik und wird als Orbitalmodell bezeichnet.
Warum ist Thomsons Atommodell falsch : Das Atommodell von Thomson konnte nicht erklären, wie die negativen Elektronen im Atom zurückgehalten werden. Weiter erklärt das Modell auch nicht, warum ein Atom überhaupt stabil ist. Erst das Rutherford-Atommodell, das im Jahr 1911 entstand, konnte die Stabilität eines Atoms erklären.
Noch heute wird der sogenannte Bohrsche Atomradius deshalb als Größe in der Atomphysik benutzt. In der Quantenmechanik ordnet man den Elektronen jedoch keine festen Bahnen mehr zu, sondern wolkenförmige Orbitale.
Das aktuelle Atommodell ist das Resultat der Quantenmechanik und wird als Orbitalmodell bezeichnet. Orbitale sind Raumbereiche, in denen sich Elektronen mit einer gewissen Wahrscheinlichkeit aufhalten. Diese Orbitale ersetzen die Bahnen des Bohrschen Atommodells.
Wo liegen die Grenzen des bohrschen Atommodells
Problem der höheren Elemente
Leider konnte mit Hilfe des Bohr'schen Atommodells nur das Spektrum des Wasserstoffatom exakt berechnet werden. Die höheren Elemente erforderten neue Quantenzahlen: l, m und s. Mit ihnen konnten die höheren Spektren zwar prinzipiell erklärt aber nicht exakt errechnet werden.Eine weitere Einschränkung des Dalton Atommodells betrifft die Vorhersage der chemischen Reaktionen. Während das Modell erklären konnte, dass Atome in einer chemischen Reaktion nur umorganisiert werden, konnte es nicht vorhersagen, welche Arten von Atomen in einer gegebenen chemischen Reaktion beteiligt sein würden.Das Orbitalmodell ist das bis heute genaueste Modell zur Beschreibung der Elektronenbahnen um den Atomkern.
Das bohrsches Atommodell war ein wichtiger Schritt in der Entwicklung von Vorstellungen über den Aufbau von Atomen. Seine Vorteile, insbesondere gegenüber dem rutherfordschen Atommodell, waren: Es ermöglichte die Abschätzung des Atomradius. Es erlaubt die Berechnung der Spektrallinien des Wasserstoffatoms.
Was war an Daltons Atommodell falsch : Eine weitere Einschränkung des Dalton Atommodells betrifft die Vorhersage der chemischen Reaktionen. Während das Modell erklären konnte, dass Atome in einer chemischen Reaktion nur umorganisiert werden, konnte es nicht vorhersagen, welche Arten von Atomen in einer gegebenen chemischen Reaktion beteiligt sein würden.
Welches ist das richtige Atommodell : Nach dem Thomsonschen Atommodell besteht das Atom aus einer gleichmäßig verteilten positiven Ladung und negativ geladenen Elektronen, die sich darin bewegen. Dieses Modell wird auch als Plumpudding-Modell oder zu deutsch Rosinenkuchenmodell bezeichnet.
Wie unterscheidet sich das Atommodell von Bohr vom Orbitalmodell
Im Gegensatz zum Bohrschen Atommodell, wo Elektronen auf bestimmte Bahnen beschränkt sind, legt das Orbitalmodell nahe, dass Elektronen in dreidimensionalen Regionen (Orbitalen) positioniert sind, in denen sie am wahrscheinlichsten anzutreffen sind. Stelle dir Orbitale als Wolken vor, in denen Elektronen schweben.
Das Problem des Bohrschen Atommodells ist, dass es aus quantenmechanischer Sicht inkonsistent ist. Insbesondere verletzt es eines der fundamentalen Gesetze der Quantenmechanik, nämlich die Heisenbergsche Unschärferelation.